Wirkungsweise
Als aktive Substanz enthält Dysport® einen Botulinumtoxin A-Komplex. Nach der Injektion in den ausgewählten hyperaktiven Muskel bindet Dysport® an die präsynaptischen Nervenendigungen, passiert die präsynaptische Membran und blockiert die Ausschüttung des Neurotransmitters Acetylcholin. Dadurch wird lokal der Muskeltonus reversibel für 3 bis 4 Monate gezielt herabgesetzt.
Anwendungsgebiete in Deutschland1
Dysport® wurde für die Behandlung neuromuskulärer Bewegungsstörungen entwickelt und ist in Deutschland für folgende Indikationen zugelassen:
- Zur symptomatischen Alternativbehandlung von idiopathischem Blepharospasmus, hemifazialem Spasmus und koexistierenden fokalen Dystonien.
- Zur symptomatischen Behandlung einer zervikalen Dystonie (Torticollis spasmodicus) mit Beginn im Erwachsenenalter.
- Zur symptomatischen Behandlung einer fokalen Spastik der oberen Extremitäten bei Erwachsenen.
- Zur symptomatischen Behandlung einer fokalen Spastik des Fußgelenkes bei erwachsenen Patienten nach Schlaganfall oder Schädel-Hirn-Trauma.
- Zur symptomatischen Behandlung einer fokalen Spastik der oberen Extremitäten bei Patienten mit infantiler Zerebralparese ab 2 Jahren.
- Zur symptomatischen Behandlung einer fokalen Spastik mit dynamischer Spitzfußstellung der unteren Extremitäten bei gehfähigen Patienten mit infantiler Zerebralparese ab 2 Jahren
- Dysport ist indiziert für die Behandlung von Harninkontinenz bei Erwachsenen mit Detrusorhyperaktivität infolge einer Rückenmarksverletzung (traumatisch oder nicht traumatisch) oder Multipler Sklerose, die regelmäßig eine saubere intermittierende Katheterisierung durchführen.
Die Therapieziele einer Behandlung mit Botulinumtoxin richten sich nach der individuellen Symptomatik und den Bedürfnissen des Patienten. Im Vordergrund stehen die Linderung der Symptom und Reduktion der Beeinträchtigung sowie die Verbesserung der aktiven und passiven Funktionsfähigkeit und des Erscheinungsbilds im Hinblick auf Köperpflege- und haltung.
Darreichungsform und Packungsgröße1

Eine Durchstechflasche Dysport® enthält ein Pulver, das durch Zugabe von physiologischer Kochsalzlösung zu einer fertigen Injektionslösung rekonstituiert wird.
Erhältlich ist Dysport® 300 Einheiten in Packungen mit einer Durchstechflasche (N1), sowie Packungen mit Dysport® 500 Einheiten mit einer (N1), zwei (N2) oder sechs (N3) Durchstechflaschen. Dysport® ist verschreibungspflichtig.
Rekonstitution1
Dysport®:
LAGERUNGSDAUER UND -BEDINGUNGEN
Lagerungsbedingungen
- Gekühlt bei Temperaturen zwischen 2°C und 8°C lagern.
- Nicht einfrieren
Lagerungsdauer
- Ungeöffnete Durchstechflaschen können für 24 Monate gelagert werden.
- Rekonstituierte Lösung:
• Verwendung sofort nach der Rekonstitution wird empfohlen.
• Gebrauchsfertige Injektionslösung bei 2°C – 8°C maximal 24 Stunden aufbewahren.
Dysport®:
ENTSORGUNG
- Injektionsnadeln, Injektionsspritzen und Durchstechflaschen – die nicht geleert werden sollten – müssen in einen geeigneten Behälter, der nach Gebrauch der Müllverbrennung zugeführt wird, entsorgt werden.
- Verschüttetes Dysport® ist mit einem saugfähigen und mit verdünnter Hypochloritlösung getränkten Tuch aufzuwischen.
Zubereitung von Dysport®:
VERDÜNNUNG
- Das Herstellen der gebrauchsfertigen Dysport®-Injektionslösung erfolgt direkt nach Entnahme aus dem Kühlschrank.
- Die Anweisungen zur Rekonstitution sind jeweils spezifisch für die Durchstechflaschen mit 300 Einheiten bzw. mit 500 Einheiten. Diese Volumina liefern Konzentrationen, die spezifisch für die Anwendung für jede der Indikationen sind.
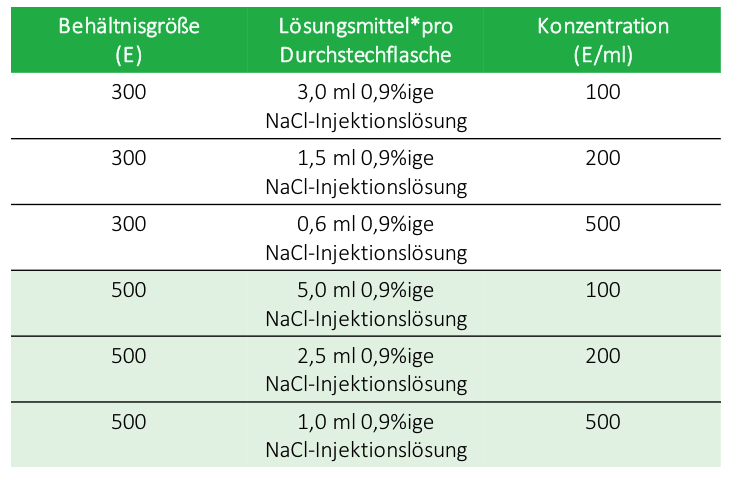
*Konservierungsmittelfreie 0,9%ige Natriumchlorid-Injektionslösung
GRUNDLEGENDE SCHRITTE
- Die präzise und sichere Zubereitung und Verabreichung von Dysport® ist durch Einhaltung der folgenden grundlegenden Schritte sicherzustellen:




Langjährige Kompetenz
Das Botulinumtoxin A von Ipsen ist in Deutschland seit 1993 zugelassen. Ursprünglich als europäisches Produkt bekannt (Dysport® wird in Großbritannien hergestellt) ist das Botulinumtoxin A von Ipsen inzwischen weltweit in über 75 Ländern präsent, neben Europa vor allem in den USA, Südamerika und Asien. Für Ipsen Pharma in Deutschland ist Dysport® ein wichtiges Produkt. Seit Mitte der 80er Jahre garantiert die enge Zusammenarbeit mit unseren Kunden bei innovativen Therapieansätzen, klinischen Studien, Fortbildungen und Projekten die kontinuierliche Weiterentwicklung von Dysport® und die exzellenten Langzeitergebnisse.
Fachinformation und Gebrauchsinformation
Anwendungsgebiete
• Zur symptomatischen Alternativbehandlung von idiopathischem Blepharospasmus, hemifazialem Spasmus und koexistierenden fokalen Dystonien.
• Zur symptomatischen Behandlung einer zervikalen Dystonie (Torticollis spasmodicus) mit Beginn im Erwachsenenalter.
• Zur symptomatischen Behandlung einer fokalen Spastik der oberen Extremitäten bei Erwachsenen.
• Zur symptomatischen Behandlung einer fokalen Spastik des Fußgelenkes bei erwachsenen Patienten nach Schlaganfall oder Schädel-Hirn-Trauma.
• Zur symptomatischen Behandlung einer fokalen Spastik mit dynamischer Spitzfußstellung der unteren Extremitäten bei gehfähigen Patienten mit infantiler Zerebralparese ab 2 Jahren.
Hinweis
Der Patient ist vor Beginn einer Therapie mit Dysport® darauf hinzuweisen, dass daneben noch andere (medikamentöse, chirurgische) Behandlungsmethoden bestehen, und dass nicht alle Patienten auf die Behandlung mit Dysport® ansprechen bzw. nur eine partielle Symptomlinderung eintritt. Voraussagbare Faktoren für die nicht gegebene bzw. verminderte Ansprechbarkeit sind nicht bekannt.
Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Andere peripher wirkende Muskelrelaxanzien ATC-Code: M03AX21. Clostridium botulinum Toxin Typ A blockiert die cholinerge Übertragung an der motorischen Endplatte durch eine Unterbindung der Freisetzung von Acetylcholin. Der Wirkungsmechanismus des Neurotoxins umfasst zunächst eine spezifische und sättigbare Bindung an die extrazellulären Rezeptoren. Durch einen pinozytoseähnlichen, energieabhängigen Prozess wird das Neurotoxin dann ins Zellinnere (Internalisation des Toxins) aufgenommen. Im Zellinnern wirkt das Neurotoxin wahrscheinlich als Enzym auf eine zelluläre Komponente ein, deren Funktion in der Regulierung der Calcium-abhängigen Exozytose von Acetylcholin besteht. Die Nervenendigungen der motorischen Endplatte sprechen auf die Nervenimpulse nicht mehr an und es erfolgt keine Sekretion des Chemotransmitters (chemische Denervierung des Muskels). Nach Eindringen des Neurotoxins ins Zellinnere erfolgt wahrscheinlich eine enzymatische Zersetzung der Strukturen der motorischen Endplatte. Die Wiederherstellung der Impulsübertragung erfolgt über die neu gebildeten Nervenendigungen und motorischen Endplatten, die während der Regenerationsprozesse entstehen. Der Prozess der Neubildung von Nervenendigungen beginnt ca. 8 Wochen nach Toxinverabreichung. Diese Strukturen weichen anatomisch teilweise von den bisherigen ab, sind jedoch ausreichend funktionsfähig. Nach wiederholter Verabreichung des Neurotoxins werden die neu gebildeten Nervenendigungen und motorischen Endplatten erneut lädiert. Die Langzeitfolgen dieser kumulativen Schädigung sind nicht bekannt. Tierexperimentelle Untersuchungen zeigen, dass Clostridium botulinum Toxin Typ A die cholinerge sympathische und parasympathische Impulsübertragung blockieren kann. Die Impulsleitung entlang der Nerven wird wahrscheinlich nicht beeinflusst. Das Neurotoxin hat keinen Einfluss auf die Funktion sensibler Nervenendigungen. In vitro-Untersuchungen zeigen, dass Clostridium botulinum Toxin Typ A die Freisetzung anderer Neurotransmitter als Acetylcholin hemmen kann. Unbeeinflusst bleibt lediglich die purinerge und peptiderge Impulsübertragung.
Tabelle :
MAS-Änderung von der Basislinie in der 4. und der 12. Woche, PGA und GAS in der 4. und der 12. Woche (ITT (intention-to-treat)-Population)
| Parameter | Placebo (N = 77) |
Dysport 10 Einh.7kg/Bein (N = 79) |
Dysport
15 Einh./kg/Bein (N = 79) |
| LS mittlere Änderung von
der Basislinie für den MAS Wert der Plantarflexoren des oberen Sprunggelenks 4. Woche |
– 0,5
|
– 0,9**
|
– 1,0***
|
| LS durchschnittlicher Wert
für PGA zum Ansprechen auf die Behandlung 4. Woche |
0,7
|
1,5***
|
1,5***
|
| LS durchschnittlicher GAS
Wert [a] 4. Woche |
46,2
|
51,5***
|
50,9**
|
* p ≤ 0,05; **p ≤ 0,003; ***p ≤ 0,0006 verglichen mit Placebo;
LS = least square (kleinstes Quadrat)
[a] Der GAS Wert misst den Fortschritt in Bezug auf die Ziele, die an der Basislinie aus einer Liste von zwölf Kategorien ausgewählt wurden. Die fünf am häufigsten gewählten Ziele waren ein verbessertes Gehmuster (70,2 %), verbessertes Gleichgewicht (32,3 %), verringerte Häufigkeit von Stürzen (31,1 %), verringerte Häufigkeit zu stolpern (19,6 %) und verbesserte Ausdauer (17,0 %).
Fachinformation Gebrauchsinformationen1. Dysport® Fachinformation, Stand: Stand: Juli 2022

